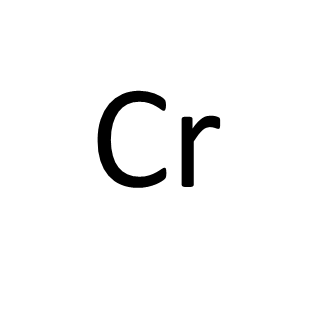水質有害物質特論では1~17章で出題傾向が明確にあります。
出題傾向の記事は下の記事をご参照ください。
1~17章において、ほぼ毎年出題される章があります。
今回解説する3章のクロム(VI)からもほぼ毎年出題されます。
そこで、本記事で内容を理解し、公式の本で詳細を読み込むことをオススメします。
(※あえて内容を省いているところがあるので、ご注意ください。)
3章の内容紹介
3章はクロム(VI)Cr6+が含まれる排水の処理方法を説明した章です。
基本的にはCr6+をCr3+に還元して、水酸化物法で処理を行います。
(水酸化物法が分からない方は【水質有害物質特論】IV.1 有害物質処理技術の概要 簡単解説をご覧ください。有害物質処理の基礎技術になるため、理解が必須です。)
還元処理をする必要があるため、「どのように還元するのか?」という内容に主眼が置かれています。
なお、Cr6+を還元する理由は、Cr6+は水酸化物を生成しないからです。
Cr6+は水溶液中でクロム酸となっています。
このクロム酸イオンが問題です。
酸性化ではCr6+はニクロム酸イオンとして存在し、アルカリ性ではクロム酸として存在します。
Cr2O72- + 2OH– ⇄ 2CrO42- + H2O
酸性時が左辺、アルカリ性時が右辺です。
観て頂くと分かりますが、Cr6+は陰イオンとなっています。
そのため、Cr6+は水酸化物法が適用できず、Cr3+に還元する必要があります。
亜硫酸塩還元法
Cr6+をCr3+に還元する方法の一つ目が亜硫酸塩(NaHSO3)還元法です。
基本的には亜硫酸塩を排水に添加するだけでCr3+に還元することが出来ます。
しかし、効率よく還元するには他に重要なことがあります。
それは、pHとORP計の制御です。
亜硫酸を添加する際に、添加量をカンで決めてはCr6+を還元しきれなかったり、逆に過剰に亜硫酸塩を添加するとコストなどの面で問題があります。
そこで、亜硫酸塩の添加量はORP計で制御します。
Cr6+がCr3+になるにつれて、電位が変化します。
そして、Cr6+が全てCr3+になると電位の変化が止まります。
この電位を測定する機械がORP計です。
 しかし、ORP計の電位変化の傾きはpHの値によって変化します。
しかし、ORP計の電位変化の傾きはpHの値によって変化します。
 図を見て頂くと分かると思いますが、pHが3.0では電位の変化が緩やかで亜硫酸塩の添加量の止め時が分かりません。
図を見て頂くと分かると思いますが、pHが3.0では電位の変化が緩やかで亜硫酸塩の添加量の止め時が分かりません。
また、亜硫酸塩の添加量をpH1.0の時よりも多くする必要があります。
そのため、pH3.0未満にすることが好まれます。
また、pHを下げるために、初めに硫酸が使用されます。
手順をまとめると以下になります。
- H2SO4を添加 :pHを酸性にする
- NaHSO3を添加 :Cr6+をCr3+に還元
- NaOHを添加 :Cr3+を水酸化物にする
- 高分子凝集剤を添加 :水酸化物を凝集させる
鉄(II)塩還元法
亜硫酸塩の代わりに鉄(II)塩を使用する場合もあります。
鉄(II)塩の利点は、強酸性から強アルカリ性の広いpH範囲で還元が出来る点です。
さらに、Fe2+イオンを含む排水を利用できるといった利点もあります。
しかし、鉄イオンが含まれるため、水酸化鉄が多量に生成されます。
また、ORP計による制御が困難といった問題があります。
しかし、溶存酸素計(DO計)を使用した制御が実用化されています。
その原理をご紹介します。
pH5以上ではFe2+イオンは以下の反応を起こします。
2Fe2+ + 1/2O2 + H2O → 2Fe3+ + 2OH–
しかし、Cr6+の還元との反応が先に生じます。
つまり、Cr6+の還元が終わった後に上の反応が起きます。
そのため、Cr6+の還元が終わると廃液中の溶存酸素が下がります。
この酸素の減少から鉄(II)塩の添加量を制御します。
なお、DO計による制御はpH5~pH12の範囲で適用可能です。
電解還元法
Cr6+の還元を電解で行う方法も考案されています。
陰極では還元反応が起こります。
そのため、排水中で電解を行うと、陰極で以下の反応が生じてCr3+が生成されます。
Cr2O72- + 14H+ +6e– → 2Cr3+ + 7H2O
上の式から、H+を増やした方がCr3+を効率よく生成できます。
そのため、酸を添加することが好まれます。
また、濃厚溶液の方が電気が流れやすいため、一般に電解還元法は濃厚廃液の処理に適用されます。
イオン交換法、吸着法
クロム酸はイオン交換樹脂への選択性が高いため、強塩基性陰イオン交換樹脂に通水すれば除去が可能です。
また、活性炭でも除去が可能となります。
ただし、Cr6+は除去可能ですが、Cr3+は除去しにくいといわれています。
なお、イオン交換法も活性炭による吸着法も大規模排水の処理には適しません。
まとめ
3章はCr6+を処理する方法を説明した章です。
この章からほぼ毎年問題が出題されるため、しっかり勉強しましょう。
Cr6+はクロム酸イオンとして、陰イオンで存在するため水酸化物法による処理が出来ません。
しかし、Cr3+には水酸化物法による処理が適用できます。
そのため、この章のポイントはどのようにCr6+をCr3+に還元するかです。
方法としては4つあります。
- 亜硫酸塩還元法
- 鉄(II)塩還元法
- 電解還元法
- イオン交換法、吸着法
特に、亜硫酸塩還元法と鉄(II)塩還元法は問題として出しやすいので、しっかり勉強することをオススメします。