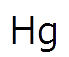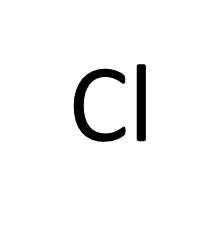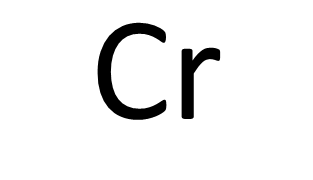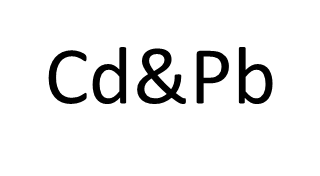水質有害物質特論において、この章からは毎年問題が出題されています。
そのため、本を読みこんで理解しておきたいです。
しかし、あまり親切な構成では書かれていないので、この章の解説をしたいと思います。
この記事を読むことで1章の内容が理解しやすくなります。
なお、あえて省いている内容もあるので、公式の本を読むことを推奨します。
1章の内容紹介
まず初めに、この章の内容をご説明します。
水質有害物質特論の2~16章では各物質(たとえばCr(VI))の処理方法について記載されています。
そして、この章では処理方法の具体的な内容について説明しています。
そのため、この章の理解が不十分だと2~16章を呼んでも理解できないことは簡単に想像できます。
この章は土台固めというわけです。
処理技術の説明と方法の一覧
工場などから出る排水をなんの処理もせずに放出するとどうなるでしょうか?
その結果が水俣病やイタイイタイ病です。
それらの被害を出さないためにも排水中の金属成分などの有害物質を取り除く必要があります。
では、どのように取り除くのでしょうか?
基本的な方法は沈殿です。
排水中の金属成分は溶けた状態ですが、様々な方法で溶けない状態にすることができます。
水に溶けた砂糖をどうにかして沈殿させる、というイメージが近いです。
沈殿させることで多くの金属成分を除去することができますが、全てではありません。
そして、微量存在するだけで環境に悪影響な物質も存在します。
そうした、物質に対しては吸着という方法を使用して微量の成分まで除去します。
イメージは下の図です。
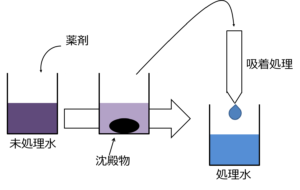
では沈殿処理の方法にはどのような種類があるのでしょうか?
その一覧が下になります。
- 水酸化物法
- 硫化物法
- フェライト法・鉄粉法
また、吸着法に関しては基本はイオン交換法が使用されます。
(活性炭法もありますが、1章の範囲外)
水酸化物法
もっとも汎用性が高く、もっとも使われている方法です。
この方法の解説をしていきます。
排水中の金属成分は溶けている状態、つまりイオン化しています。(Mn+:Mは金属を意味します。)
ここで、薬剤を添加してpHをアルカリ性にすると溶けていた金属は水酸化物M(OH)nとなります。
この水酸化物は溶けにくいため、溶けていた金属が溶けなくなり沈殿するのです。
pHがアルカリ性になると水酸化物が生成されるため、薬剤を添加しています。
では、酸性側で水酸化物が出来れば、薬剤の添加量が減らせるため経済的にもよさそうです。
そんな、酸性側で水酸化物を生成させる方法が共沈法です。
共沈法
例えば、Cdが入った排水に塩化鉄(III)(FeCl3)を入れておくことで理論的に溶解するpHより1~2低い、つまり酸性側で水酸化物が生成することが知られています。
基本的には塩化鉄(III)ですが、適用pHが中性ならアルミニウム塩、アルカリ性であればFe2+塩も使用されます。
置換法
以上が水酸化物法の説明です。
しかし、昨今の排水は水酸化物法を単に適用しても金属成分が除去できなくなっています。
理由は金属成分が錯体化されているからです。
錯体というのは金属が他の化学物質で拘束されていることです。
拘束されているため、簡単に水酸化物になれないのです。
ではどうすれば良いでしょうか?
答えは拘束されている金属成分を他の金属に変えてしまう(置換してしまう)のです。
使用される金属はMg、およびFeとCaです。
- Mg塩法
- Fe+Ca塩法
と呼ばれます。
基本的にはFe+Ca塩法が一般的です。
拘束している化学物質をXとすると以下で表す反応が起きます。
Mg塩法
X・M + Mg2+ → X・Mg + Mn+ → X・Mg + M(OH)n
Fe+Ca塩法
X・M + Fe2+ → X・Fe + Mn+ + Ca2+ → X・Ca + M(OH)n + Fe(OH)2
見ていただければ分かる通り、Xに拘束されていたMがMgとFe、Caに置換されて放出されています。
Mが放出されてしまえばあとは水酸化物法を適用することができます。
Fe+CA塩法の重要な点は、先にMをFe2+で置換し、その後、FeとCaを置換するためにCa2+で置換するところです。
pHを上げるために使用される薬剤
ところで、水酸化物法を行うためにはpHを上げる必要があります。
その際に排水に薬剤を添加してpHを上げます。
使われる薬剤を一覧にしました。
- カセイソーダ(水酸化ナトリウムNaOH)
- 消石灰(水酸化カルシウムCa(OH)2)
- 水酸化マグネシウムMg(OH)2
- 石灰石(硝酸カルシウムCaCO3
- ソーダ灰(炭酸ナトリウムNa2CO3
これらの違いは価格、中和速度です。
また、それぞれにスケール発生や凝集阻害作用の低減などの特色が加わります。
以上をまとめた表が下になります。(価格、中和速度、スケール発生、補足)
| 価格 | 中和速度 | スケール発生 | 補足 | |
| NaOH | 速い | 無い | 使いやすい | |
| Ca(OH)2 | NaOHより安い | する | 凝集阻害作用を軽減 | |
| Mg(OH)2 | 遅い | 汚泥減容効果あり | ||
| CaCO3 | Ca(OH)2より安い | 遅い | 適用PHが5くらい | |
| Na2CO3 |
硫化物法
水酸化物法は優秀な方法です。
しかし、水酸化物は溶けにくいといっても、微量は溶けます。
そのため、微量でも存在させたくない金属、特に水銀Hgには水酸化物法は適用できません。
では、どうすれば良いでしょうか?
水酸化物よりも溶けにくい化合物にすれば良いのです。
それが硫化物です。
硫化物は水酸化物よりもはるかに溶けにくい化合物として知られています。
よって、水銀も硫化物にしてしまえばほぼ完ぺきに排水から水銀を取り除けそうです。
この硫化物を生成する方法を硫化物法と呼びます。
硫化物法のメリット
硫化物法が水酸化物法よりも優れた点は、金属の処理能力以外にもあります。
それは適用可能pHです。
硫化物法はpHが中性付近でも使用できるという点で水酸化物法よりも優れた方法となります。
硫化物法のデメリット
硫化物法では、硫化水素が問題となります。
硫化水素は毒性や強烈な臭気、腐食性があるため非常に適用しにくく、水銀以外には使用されていません。
また、安全を考えて硫化ナトリウムを過剰に入れる必要がありますが、生成した硫化物が多硫化物を生成し、再溶解するという問題もあります。
ただし、多硫化物の生成は、鉄塩を添加することで、過剰な硫化物イオンが反応してFeSを生成し無害化できます。
さらに、鉄塩を添加することで共沈効果も望むことができます。
フェライト法・鉄粉法
令和1年度の試験でフェライト法が出題されました。
理解が少し難しい方法になります。
どちらも、金属イオンを金属に変える方法となります。
フェライト法
フェライトはMO・Fe2O3で表される化合物の総称です。(MはCaやZnなどの金属成分)
スピネル形結晶をもつ磁性体結晶をマグネタイトと呼びます。
マグネタイトを生成するときに、MOつまり、除去したい金属も生成されるため、様々な金属を一括処理することができます。
生成条件は、反応温度60℃以上、2NaOH/FeSO4=1、pH9以上のアルカリ性です。
フェライト法には金属の一括処理以外にも、スラッジ(沈殿物)から溶出しにくいという特性もあるため、研究室や分析室の小規模排水の処理に適しています。
ただし、汚泥発生量が多いという欠点があります。
鉄粉法
銅Cuなどのイオン化傾向が小さい金属イオンは鉄Feなどのイオン化傾向が大きい金属と接すると、Cuが金属として析出し、Feがイオン化することが知られています。
Fe + Cu2+ → Fe2+ + Cu
そのため、鉄片を酸性溶液に接触させて、新鮮な金属面を露出させ排水に投入することでイオン化傾向の小さい金属を還元析出させることができます。
この手法を鉄粉法と呼びます。
鉱山排水において、ダライ粉法として、銅の回収に適用されていました。
イオン交換法
イオン交換法は高度処理としてよく使用される方法です。
水中の陽イオン(金属イオンなど)を別の陽イオンと交換する樹脂を陽イオン交換樹脂、
逆に陰イオン(Cl–など)を別の陰イオンと交換する樹脂を陰イオン交換樹脂と呼びます。
交換基の解離度によって強酸(強塩基)性樹脂、弱酸(弱塩基)性樹脂に分類されています。
イオン交換法を使用すると、微量な金属も除去できます。
また、水酸化物法などは金属を選択的に除去することができませんでしたが、イオン交換法では選択的に除去することも可能です。
スラッジ処理
ところで、水酸化物法などで沈殿させた金属をどのように処理するのでしょうか?
そのまま土壌に埋めては雨や地下水によって、金属成分が溶出して環境に悪影響を与えることが予想できます。
そうならないように、金属を溶出しないよう封鎖、固化する方法が必要です。
その方法として以下の4つの方法が提案されています。
- セメントやアスファルトで固化
- 焼結処理
- プラスチックで溶融固化
- 化学薬剤で難燃性塩として安定化
ただし、これらの方法も完璧ではありません。
例えば、コンクリート固化では、スラッジ(沈殿物)によって固化が不可能であったり、溶出が完全に防げない場合があります。
焼結処理は、焼結物がれんがなどに活用できる点でコンクリート固化より優秀ですが、
有害物質が全て安定化されるとは限りません。
また、Cr3+→Cr6+のようにクロムが酸化されてCr(VI)が生成され、水に溶解しやすくなる場合もあります。
有害物質の有効活用
先ほどまでは有害物をどう捨てるか、という話でした。
しかし、有害物質を再利用できればそれに越したことはありません。
実際に再利用した事例があります。
目的とする金属成分をある程度以上含有するスラッジを、原料とともに溶鉱炉に入れる山元還元法と呼ばれる方法です。
溶鉱炉以外にも様々な再利用法があり以下にまとめました。
- 銅排水の処理スラッジの銅精錬炉への還元
- 金、銀、パラジウムなどの貴金属を含むめっき廃液の電解還元改修
- アルミ排水の処理スラッジからの副生硫酸アルミニウムの製造
- 鉄使用排水などの酸化鉄(III)のフェライト減量化
- 金属精錬過程で副生するダストなどからの亜鉛、カドミウム、鉛の回収
- 半導体製造プロセスの含ふっ素排水からのフッ化カルシウムスラッジをふっ酸製造工場で再資源化
なお、これらの再利用として重要な点はスラッジの含水率です。
含水率が高い場合、スラッジの移動=水の移動となり無駄なエネルギーを使用しているからです。