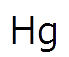水質有害物質特論では1~17章で出題傾向が明確にあります。
出題傾向の記事は下の記事をご参照ください。
1~17章において、ほぼ毎年出題される章があります。
今回解説する4章の水銀排水の処理もほぼ毎年出題されます。
(平成28年からは毎年出題されています。)
そこで、本記事で内容を理解し、公式の本で詳細を読み込むことをオススメします。
(※あえて内容を省いているところがあるので、ご注意ください。)
4章の内容
4章の内容は水銀排水方法についてですが、基本的には硫化物法である程度の水銀を処理したのちに、吸着法で基準値以下まで処理するというプロセスとなっています。
それ以外に、有機水銀の場合には有機水銀を塩素によって分解し、水銀イオンにするという工程が足されます。
水銀イオンにしたら、硫化物法を行い、最後に吸着法です。
まとめると以下の工程になります。
- (有機水銀の分解)
- 硫化物法
- 吸着法
硫化物法
多くの金属イオンは硫化物イオン(S2-)と反応し、極めて難溶性の塩を生成します。
そのため、排水基準が厳しい水銀に硫化物法が適用されています。
硫化物法は硫化ナトリウムや硫化水素などをS2-の素として排水に添加することで行います。
しかし、S2-が過剰すぎると多硫化物が形成され再溶解するという欠点があります。
そこで、鉄(II)や鉄(III)が併用されます。
鉄イオンを添加することで、過剰のS2-と鉄イオンが反応し多硫化物の生成を抑えてくれるというわけです。
吸着法
硫化物法は有害金属を低濃度にできる優れた手法ですが、安定的に水銀の基準値以下の濃度にすることは困難です。
そこで、硫化物法を適用した後の排水を、後処理として吸着法でさらに処理することが一般的です。
吸着法のための吸着材として二種類あります。
- 活性炭
- 水銀キレート樹脂
です。
活性炭
吸着材として最も一般的に使用されるものが活性炭です。
活性炭の利点は、水銀の吸着量が比較的多いため、前処理としても使えるという点です。
使用する際は、pH1~6の酸性の方が吸着効果が良くなります。
水銀キレート樹脂
もう一つの吸着材が水銀キレート樹脂です。
水銀キレート樹脂の利点は水銀を0.00005 mg/L以下まで処理することが出来るという点です。
水銀キレート剤の特徴は硫黄系の官能基を有していることです。
チオール基やジチオカルバミド基など「チオ」が名前についています。
また、水銀キレート樹脂は化学反応で吸着を行うため、水銀をイオン化する必要があります。
イオン化の方法は、pHを2~6の酸性に調整し、塩素酸化してイオン化させます。
ただし、硫黄官能基は塩素に弱いため、塩素の添加量は5 mg/L程度に抑える必要があります。
有機水銀の分解
先ほども述べたように有機水銀排水は、有機水銀を塩素で分解し、硫化物法および吸着法で処理します。
塩素によって有機水銀は、塩化水銀(II)へと分解されます。
その際、アルキル基が長いほど分解しやすく、短いほど分解し難い、という性質があります。
ただし、塩素酸化による分解はpHに大きく影響され、
pH1以下の強酸性条件下ではCH3-Hg結合が完全に破壊されます。
まとめ
水銀排水は硫化物法の後、吸着法で処理されます。
硫化物法では
S2-が過剰すぎると多硫化物が生成され再溶解されます。
そこで、鉄イオンと併用されることで多硫化物の生成を抑えられます。
吸着法では、活性炭と水銀キレート樹脂が主に使用されます。
活性炭は吸着量が多く、前処理としても使用できるという特徴があります。
一方、水銀キレート樹脂は水銀を0.00005 mg/L以下まで減少させることが出来ます。
使用する際は塩素酸化により水銀イオンを形成しますが、塩素を5 mg/L程度に抑える必要があります。
最後に有機水銀の分解です。
有機水銀の分解も塩素酸化で行います。
分解は、アルキル基が長いほうが容易に行えます。
しかし、pH1以下の強酸性条件下ならCH3-Hg結合を完全に破壊することが可能です。